УЧЕБНИК Онкология. Ш. X. Ганцев 2006. Учебник для студентов медицинских вузов. 2е изд., испр и доп. М. Ооо Медицинское информационное агентство
 Скачать 4.2 Mb. Скачать 4.2 Mb.
|
|
Глава 12. Рак пищевода С15.00.1.1.5.3. Ультразвуковое исследование шеи С15.00.1.1.5.4. Ультразвуковое исследование средостения С15.00.1.1.5.5. Ультразвуковое исследование надключичных зон С15.00.1.1.5.6. Эндосонография пищевода С15.00.1.1.6. ЭКГ стандартная С15.00.1.1.7. Исследование функции внешнего дыхания С15.00.1.1.8. Билатеральный тест по Бергану С15.00.1.1.9. Консультация заведующего отделением С15.00.1.1.10. Консультация гинеколога (при обследовании женщин) С15.00.1.1.11. Консилиум хирурга, лучевого специалиста, химиотерапевта, эндоскописта, рентгенолога С15.00.1.1.12. Консультация анестезиолога С15.00.1.1.13. Консультация терапевта С15.00.1.1.14. Врачебный осмотр в приемном отделении (в случае госпитализации) С15.00.1.2. ФАКУЛЬТАТИВНЫЕ ПРОЦЕДУРЫ С15.00.1.2.1. Пункция периферических лимфатических узлов, загрудин-ных лимфатических узлов, лимфатических узлов шеи, лимфатических узлов средостения С15.00.1.2.2. Манипуляции под контролем ультразвукового исследования С15.00.1.2.2.1. Пункционная биопсия печени, почек, забрюшинных лимфатических узлов, лимфатических узлов шеи, средостения, надключичных зон, щитовидной железы С15.00.1.2.2.2. Пункция и катетеризация плевральной полости С15.00.1.2.2.3. Пункция и катетеризация брюшной полости С15.00.1.2.2.4. Пункция и катетеризация средостения С15.00.1.2.3. Ультразвуковое исследование органов малого таза С15.00.1.2.4. Ультразвуковое исследование щитовидной железы С15.00.1.2.5. Лапароскопия (с биопсией) Примечание. Выполняют при опухолях нижней трети пищевода. С15.00.1.2.6. Прескаленная биопсия (по показаниям) С15.00.1.2.7. Компьютерная томография пищевода С15.00.1.2.8. Компьютерная томография брюшной полости С15.00.1.2.9. Радионуклидная диагностика метастазов С15.00.1.2.10. Сканирование костей скелета, головного мозга С15.00.1.2.11. Радиоизотопная ренография С15.00.1.2.12. Велоэргометрия С15.00.1.2.13. Консультация специалистов (по показаниям) 12.7. ЛЕЧЕНИЕ РАКА ПИЩЕВОДА Основными методами лечения рака пищевода являются: ♦ хирургический; ♦ лучевой; Часть П. Частная онкология ♦ комбинированный (сочетающий лучевой и хирургический компоненты); ♦ комплексный (представляющий сочетание хирургического, лучевого и лекарственного (химиотерапевтического) методов лечения). Низкая чувствительность опухоли к существующим химиопрепаратам, паллиативный и кратковременный эффект лучевой терапии делают хирургическое вмешательство методом выбора в лечении больных раком пищевода. История широкого применения хирургического метода лечения рака пищевода насчитывает чуть более 50 лет. Применение хирургического лечения сдерживалось отсутствием надежных способов анестезии, что существенно удлиняло время оперативного вмешательства, и отсутствием отработанной методики пластического этапа хирургического лечения. Это обусловило длительное существование двухэтапного способа оперативного лечения. Первым этапом была операция Добромыслова—Торека (экстирпация пищевода с наложением шейной эзофагостомы и гастростомии), вторым этапом — пластика пищевода по одной из многочисленных разработанных методик. Для пластики использовались практически все отделы пищеварительного тракта: тонкая кишка и различные отделы толстой, применялись различные методы пластики целым желудком и желудочными лоскутами. Существовало множество способов расположения трансплантата: пред-грудинный, ретростернальныи, в ложе удаленного пищевода, и даже, ныне практически не применяемый, способ кожной пластики. В СССР впервые операцию Добромыслова—Торека выполнил в 1945 г. В. И. Казанский; годом позже резекцию пищевода с одномоментной пластикой произвел Б. В. Петровский. Высокая послеоперационная летальность, техническая сложность вмешательства, громоздкая система многоэтапных операций — все эти факторы поделили хирургов на два лагеря. Большинство ведущих отечественных хирургов (Б. В. Петровский, В. И. Казанский, Ф. Г. Углов, А. А. Русанов) были сторонниками радикального удаления пораженного органа или его части при незапущенных формах заболевания и не возражали против лучевой терапии. Другие хирурги и онкологи (Б. Е. Пе-терсон, Б. С. Розанов) критически оценивали возможности хирургического лечения рака пищевода, особенно его высоких локализаций, и отдавали предпочтение методам лучевой терапии. Совершенствование хирургической техники, анестезиологического пособия, выбор оптимальной лечебной тактики обусловили превалирующую роль хирургического лечения рака пищевода. Современные принципы хирургии рака пищевода: 1) максимальная безопасность вмешательства: правильный выбор оперативного доступа и объема хирургического вмешательства; 2) онкологическая адекватность: мобилизация «острым путем» по принципу от сосуда к пораженному органу, правильная последовательность мобилизации пораженного органа с целью профилактики интраоперационной диссеминации, моноблочной лимфодиссекции; Глава 12. Рак пищевода 3) высокая функциональность: выбор рационального метода пластики, формирование технически простого антирефлюксного анастомоза (Давыдов М. И., 2000). Сравнительный анализ эффективности одномоментных и многоэтапных операций показал преимущество первых по показателям послеоперационной летальности (6,6 %), завершенности лечения (98 %) и отдаленным результатам (33 % 5-летней выживаемости). При определении показаний к хирургическому лечению необходимо учитывать, что раком пищевода чаще всего страдают лица в возрасте 60 лет и старше, имеющие целый ряд сопутствующих заболеваний, особенно сердечно-сосудистой и дыхательной систем, что ограничивает возможность применения операций. Кроме того, рак пищевода сравнительно рано приводит к нарушению питания и расстройству всех видов обмена веществ, что повышает риск оперативных вмешательств. Таким образом, выбор оптимального метода лечения для каждого больного раком пищевода является трудной задачей. В каждом конкретном случае необходимо строго учитывать состояние больного, степень нарушения питания, распространенность процесса, технические возможности оперирующего хирурга, обеспечение адекватного послеоперационного ухода. В настоящее время применяются два основных способа оперативных вмешательств: 1. Экстирпация пищевода с пластикой изоперистальтическим желудочным лоскутом с внеплевральным анастомозом на шее (рис. 12.7) в виде трансплеврального удаления пищевода или внеплевральной экстирпации — трансхиатальным доступом (А. Ф. Черноусов, А. С. Мамонтов, Р. М. Та-зиев и др.). Метод позволяет подвергнуть хирургическому воздействия все отделы пищевода вплоть до глотки и даже с резекцией ротоглотки. Нахождение анастомоза на шее вне плевральной полости существенно снижает риск несостоятельности анастомоза, и она не является фатальной. В то же время часты случаи рубцового стеноза анастомоза. Следует 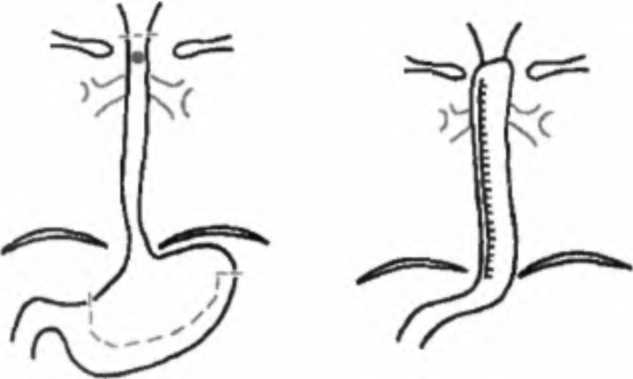 Рис. 12.7. Схема операции — экстирпация пищевода с пластикой изоперистальтическим желудочным лоскутом с внеплевральным анастомозом на шее Часть . Частная онкология подчеркнуть, что трасхиатальный способ (без торакотомии) резекции пищевода имеет ограниченное применение при опухолях больших размеров. К сожалению, большинство авторов заявляет о преобладании операций при распространенных опухолевых процессах. 2. Резекция пищевода с одномоментной внутриплевральной пластикой пищевода желудком (рис. 12.8) — операция типа Льюиса (М. И. Давыдов, П. Лозак и др.)- Этот способ практически исключает стенозирование анастомоза, обеспечивает лучшие функциональные результаты (отсутствие рефлюкс-эзофагита), однако верхние отделы внутригрудного отдела пищевода остаются недоступными для резекции (шейный, верхнегрудной отделы). Рис. 12.8. Резекция пищевода с одномоментной внутриплевральной пластикой пищевода желудком — операция типа Льюиса При выполнении операции при раке пищевода обязательным является проведение лимфодиссекции как минимум в двух полостях по зонам лимфогенного метастазирования, а при экстирпации пищевода лимфодиссекции подвергаются и шейные лимфатические узлы (Давыдов М. И., 2000). Летальность при таких видах операции находится в пределах 7-10 %. В качестве трансплантата в ряде случаев используют, кроме желудка, тонкую или толстую кишку. Не утратила своего значения операция Торека—Добромыслова в случаях невозможности одномоментного этапа пластики (состояние больного, технические особенности операции). Следует указать на возможность выполнения при нерезек-табельном раке грудного отдела паллиативных вмешательств в виде шунтирования опухолевого стеноза наложением обходного анастомоза. В случае нерезектабельной опухоли возможно наложение гастростомы. Больные раком пищевода с наложенной гастростомой могут быть подвергнуты лучевой терапии. Лучевое лечение рака пищевода остается единственным методом лечения для большинства больных, которым оперативное лечение противопоказано ввиду имеющейся у них сопутствующей патологии (выраженные расстройства 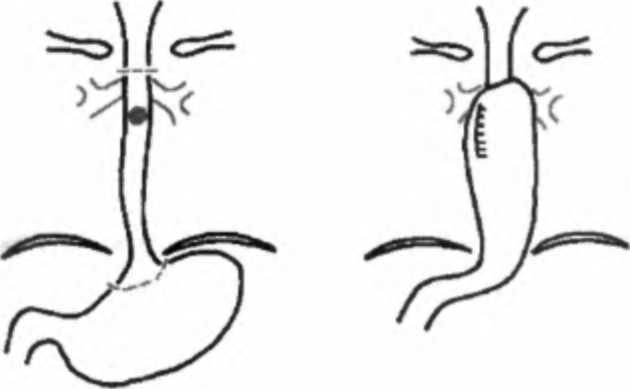 Глава 12. Рак пищевода сердечно-сосудистой, дыхательной систем и др.)> Р преклонном возрасте больных, отказе больных от операции. В ряде случаев лучевое лечение носит изначально паллиативной характер (после проведенной ранее лапаротомии и гастростомии). Применение современных методик облучения позволяет добиться исчезновения тягостных клинических проявлений заболевания у 35-40 % больных. Целью облучения является создание в области облучаемого органа терапевтической дозы в 60-70 Гр. Одновременно кроме пораженного органа в область облучения должны включаться зоны расположения лимфатических узлов возможного метастазирования: параэзофагеальные лимфатические узлы, зона лимфатических узлов паракардиальных, области левой желудочной артерии и чревного ствола, надключичных областей. Классическим методом облучения является 5 сеансов лучевой терапии в неделю в разовой очаговой дозе 1,5-2 Гр (классическое фракционирование дозы). При других вариантах фракционирования дозы, подводимые в течение дня, могут меняться, как могут меняться и разовые очаговые дозы. Весьма эффективными при раке пищевода оказались методы внутриполостного облучения. Внутриполостная лучевая терапия выполняется на аппарате АГАТ ВУ. При этом тонкий зонд с радиоактивным кобальтом вводится в просвет пищевода и устанавливается на уровне поражения. Источники излучения устанавливают на 1 см ниже и выше определяемых границ опухоли. Наиболее благоприятным следует считать сочетание дистанционного облучения с внутри-полостным. Комбинированное и комплексное лечение Стремление онкологов улучшить отдаленные результаты лечения послужило поводом к разработке и применению комбинированного метода, сочетающего лучевую терапию и операцию (Мамонтов А. С„ 1979; Ak yama Н. et al., 1981). Наиболее оправданно применение комбинированного лечения у больных с локализацией опухоли в среднегрудном отделе пищевода. Доказано, что предоперационная лучевая терапия оказывает бластостатичес-кий эффект, расширяет резектабельность, приводит к уменьшению количества местных рецидивов (Чернышев В. А., 1997). В качестве компонента комбинированного лечения лучевая терапия позволяет расширить показания к радикальному лечению местно-распространенных опухолей пищевода, повысить радикальность операций, снизить частоту местных рецидивов и метастазов. Предоперационная лучевая терапия проводится в различных вариантах. Применение методики укрупненного фракционирования дозы интенсивным ритмом по 4 Гр 5-6 раз в неделю до СОД 20-24 Гр оправдано при малой протяженности опухоли (Тх_2), при отсутствии глубокого изъязвления опухоли, при дисфагии — степени и отсутствии выраженных нарушений со стороны сердечно-сосудистой и дыхательной систем. При большей протяженности опухоли более оправданно применение методики классического фракционирования по 2 Гр 5 раз в неделю до СОД 40-45 Гр или схемы динамического фракционирования дозы — по 4 Гр 3 дня, затем по Часть П. Частная онкология 2 Гр ежедневно до СОД 36-42 Гр. Оптимальный интервал между окончанием лучевой терапии и операцией при методике укрупненного фракционирования дозы — 5-7 дней, а при методике классического и динамического фракциони- ! рования 2-3 недели. Лучевая терапия в традиционном варианте комбинированного лечения используется перед операцией, однако в клинической практике возникают такие ситуации, когда проведение лучевой терапии до операции не осуществлено либо из-за высокого риска развития осложнений, связанных с распадом. В этих случаях целесообразно использовать послеоперационное облучение. В случаях, когда клетки опухоли вышли за пределы ее видимых границ или остались в ее ложе, сохранив биологическую активность, целесообразно использование химиотерапии (Kelsen et al., 1984; Fuj mak M. etal., 1985). Химиотерапия применяется при низкодифференцированных формах рака пищевода и при мелкоклеточном раке пищевода. Ниже приведены федеральные стандарты по хирургическому лечению рака пищевода стадии (наиболее часто диагностируемая стадия) («Алгоритмы объемов диагностики и лечения злокачественных новообразований». — М., 2002). С15.03.* РАК ПИЩЕВОДА СТАДИИ (T3NiMo, Т4 любая N Щ С15.03.2. ЛЕЧЕНИЕ С15.03.2.1. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ С15.03.2.1.1. Полостные операции Примечание. Используемые доступы: верхнесрединный лапаротомный, правосторонняя торакотомия, комбинированный левосторонний доступ, шейная медиастинотомия. С15.03.2.1.1.1, Субтотальная резекция пищевода С15.03.2.1.1.2. Экстирпация пищевода С15.03.2.1.1.3. Абдоминальный этап — гастростомия С15.03.2.1.1.4. Проксимальная субтотальная резекция пищевода и желудка С15.03.2.1.1.5. Резекция органов при выполнении типовых операций Примечание. Объем операции определяют по показаниям. С15.03.2.1.1.6. Лимфаденэктомия Примечание. Объем лимфаденэктомии определяют по показаниям. С15.03.2.2.5. ХИМИОТЕРАПИЯ В ПЛАНЕ САМОСТОЯТЕЛЬНОГО ЛЕЧЕНИЯ Примечание: ♦ выполняют при мелкоклеточном раке пищевода, недифференцированных формах рака пищевода; ♦ выполняют 2-3 курса химиотерапии, затем оценка эффективности и выработка дальнейшего плана лечения; ♦ интервалы между курсами 3 недели. * Код МКБ-10. Глава 12. Рак пищевода С 15.03.2.2.5.1. Платидиам (курсовая доза, мг/м2— 100, разовая доза, мг/м2 — 100 в 1-й день), Этопозид (курсовая доза, мг/м2 — 360, разовая доза, мг/м2 — 120, периодичность — 3,4, 5-й дни), 5-фторура-цил (курсовая доза, мг/м2 — 1000, разовая доза, мг/м2 — 500, периодичность — 1-й, 8-й дни) С15.03.2.2.5.2. Гемзар (курсовая доза, мг/м2 — 2000, разовая доза, мг/м2 — 1000, периодичность — 1-й, 8-й дни), Цисплатин (курсовая доза, мг/м2 — 80, разовая доза, мг/м2 — 80 в 3-й день) Примечание. Используют как схему 1-й линии при всех формах местно-распро-страненного рака пищевода. С15.03.2.2.5.3. Платидиам (курсовая доза, мг/м2 — 100, разовая доза, мг/м2 — 100 в 1-й день), Этопозид (курсовая доза, мг/м2 — 360, разовая доза, мг/м2 — 120, периодичность — 3, 4, 5-й дни), Фармару-бицин (курсовая доза, мг/м2 — 60, разовая доза, мг/м2 — 30, периодичность — 3-й, 10-й дни) Примечание. Выполняют при аденокарциноме пищевода. Лучевое и химиотерапевтическое лечение необходимо проводить на фоне терапии, направленной на предупреждение и купирование возможных нарушений эритро- и лейкопоэза, иммунодепрессии (переливание препаратов крови, иммуностимуляция, инфузионная терапия, витаминотерапия). Пятилетняя выживаемость больных после комбинированного лечения достигает 56,6 % при радикальном характере оперативных вмешательств и 7,0 % после паллиативных. При комплексном лечении после паллиативных операций выживаемость достигает 30,8 % (А. С. Мамонтов, В. Г. Верещагин). Рак пищевода в большинстве случаев является относительно медленно прогрессирующим заболеванием. По степени злокачественности он находится между самыми злокачественно текущими заболеваниями и теми, которые достаточно доброкачественны. Нелеченный рак имеет плохой прогноз. Средняя продолжительность жизни таких больных не превышает 5-8 месяцев с момента появления признаков болезни. Правда, при ранней диагностике зарегистрированы случаи продолжительности жизни до 6 лет без какого-либо лечения. Прогноз заболевания при лучевой терапии зависит от формы роста опухоли. Наихудшими являются результаты при эндофитной форме роста опухоли. Трехлетние результаты при этой форме роста составляют 6,0 %, тогда как при экзофитной форме — 27 %. Применение лучевой терапии по паллиативной программе дает возможность 7-10 % больных прожить более года. Повышение эффективности лучевого лечения связывается с совершенствованием методик облучения, увеличением чувствительности опухоли к облучению за счет использования радиосенсиби-лизирующих препаратов и сочетанием с химиотерапией и иммуностимулирующими воздействиями. Продолжительность жизни после радикальных операций по поводу рака пищевода является основным и наиболее важным показателем эффективности хирургического и комбинированного лечения. При хирургическом лечении, Часть . Частная онкологи среди перенесших радикальные операции, 5-летний срок выживания зависит от различных обстоятельств. Основным является распространенность опухолевого процесса. При размерах опухоли Ti 5-летняя выживаемость составляет 46,9 %, при Т2 — 42,9 %, при Т3 — 33,7 %, при Т4 — 25 %. Наличие метастазов в лимфатические узлы является неблагоприятным фактором и значительно уменьшает срок 5-летней выживаемости (вдвое). При стадии процесса комбинированное лечение (предоперационная лучевая терапия и операция) позволяет увеличить сроки 5-летней выживаемости с 10,5 до 25,4 % (Тазиев Р. М., 2001). ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Какова эпидемиология рака пищевода? 2. Перечислите способствующие факторы рака пищевода. 3. Каковы основные формы роста рака пищевода? 4. Назовите особенности гистологической структуры рака пищевода. 5. Как происходит метастазирование при раке пищевода? 6. Назовите принципы деления рака пищевода на стадии. 7. Каковы особенности клинической картины при раке пищевода? 8. Сколько различают степеней дисфагии и в чем принцип их разделения? 9. С какими группами заболеваний необходимо проводить дифференциальную диагностику при раке пищевода? 10. Перечислите основные методы диагностики рака пищевода. 11. Каковы принципы подхода в выборе тактики лечения больных раком пищевода? 12. Чем определяются непосредственные и отдаленные результаты лечения больных раком пищевода? Глава 13 РАК ЖЕЛУДКА 13.1. ЭПИДЕМИОЛОГИЯ. ЗАБОЛЕВАЕМОСТЬ Несмотря на устойчивую тенденцию к снижению заболеваемости раком желудка, он остается одной из самых распространенных форм злокачественных опухолей человека. Ежегодно в мире раком желудка заболевают более 1 млн человек (Мерабишвили В. М., 2001). Заболеваемость раком желудка неоднородна и значительно различается в разных странах и регионах мира, что говорит о влиянии климатогеографических, бытовых, пищевых и других факторов на его возникновение. Максимальный уровень заболеваемости раком желудка в мире отмечен у мужчин Японии (114,7 на 100 ООО населения), а минимальный — у белых женщин США (3,1 на 100 000). Высокая заболеваемость раком желудка зарегистрирована в Китае, Белоруссии, России, Эстонии, Латвии, Новой Зеландии (маори) (Boyle Р., 1997). В Российской Федерации в структуре онкологической заболеваемости рак желудка занимает 3-е место после рака легкого и кожи. Заболеваемость раком желудка в России имеет тенденцию к снижению: если в 1992 г. интенсивный показатель заболеваемости составлял 38,4 на 100 000 населения, то в 2001 г. — 32,7. Наиболее высокий уровень заболеваемости отмечен в Новгородской, Нижегородской, Рязанской и Вологодской областях, где интенсивный показатель заболеваемости в 2001 г. превысил 45,0 на 100 000 населения. Смертность от новообразований желудка в России также имеет тенденцию к снижению: в 1992 г. интенсивный показатель смертности составлял 35,9 на 100 000 населения, в 2001 г. — 29,7. Отмечена убыль показателя смертности на 17,7% за период 1992-2001 гг. (среднегодовая убыль составила 2,1 %). Наибольшее количество больных раком желудка составляют лица в возрасте от 50 до 60 лет, на возраст от 40 до 50 лет приходится до 25 % от всего числа заболевших; мужчины болеют в 2 раза чаще, чем женщины. 13.2. СПОСОБСТВУЮЩИЕ ФАКТОРЫ. ЗНАЧЕНИЕ ЭКЗОГЕННЫХ И ЭНДОГЕННЫХ КАНЦЕРОГЕНОВ Факторы, определяющие заболеваемость раком желудка, связаны с социально-экономическим уровнем жизни населения. Рак желудка намного чаще Часть . Частная онкология встречается среди бедных слоев населения и реже — среди обеспеченных. Для развития рака желудка особое значение имеют характер питания и образ жизни в первые два десятилетия жизни. К экзогенным факторам риска развития рака желудка относится прежде всего диета с избытком поваренной соли, в виде соленой рыбы, мяса, овощей, морепродуктов, вызывающая осмотическое повреждение эпителия и способствующая заселенности слизистой оболочки желудка бактериями Helcobacterpylor (Hpylor ). Риск развития рака желудка увеличивается при преобладании в пище углеводов, при недостатке витаминов и микроэлементов. Большое значение в возникновении рака желудка имеет химический состав почвы и воды в районе обитания человека, что прежде всего связано с содержанием нитритов и нитратов, которые в желудке с участием микроорганизмов превращаются в нитрозамины, являющиеся сильными канцерогенами. К существенному возрастанию риска развития рака желудка ведет и курение. Определенную роль также может играть употребление алкоголя и, особенно, суррогатных спиртоводочных изделий. К эндогенным факторам, способствующим развитию рака желудка, относят: дуоденогастральный рефлюкс, внутрижелудочное формирование эндогенных субстанций типа нитрозосоединений, нарушение всасываемости и повышенная утилизация витаминов и микроэлементов, генетические и иммунологические факторы, которые при условии сохраненного защитного слизистого барьера в желудке не обладают какими-либо канцерогенными свойствами. Инициирующими факторами канцерогенеза в желудке являются продукты реакций свободнорадикального окисления, которые образуются при воспалении: радикалы кислорода, соединения азота. Антиоксиданты (витамины А, С, Е, В6, бета-каротины, фолиевая кислота, микроэлементы: селен, цинк) предотвращают образование свободных радикалов, ингибируют нитрозирование и поэтому обладают защитными свойствами и, таким образом, предотвращают развитие рака. Употребление большого количества свежих фруктов, овощей, витамина Е, зеленого чая сниж ает риск развития рака желудка. В настоящее время доказана роль наследственной восприимчивости к канцерогенным влияниям в развитии рака желудка. На генетическую составляющую приходится до трети случаев заболеваемости раком желудка. Наследственные факторы ассоциируются преимущественно с диффузным типом рака желудка. У прямых родственников больных с диффузным типом рака желудка риск заболеть выше в 6 раз. Диффузный тип рака желудка чаще ассоциируется у больных с группой крови А(П), а в некоторых регионах — с группой 0(1). Особую роль в желудочном канцерогенезе играет бактерия Hpylor — рис. 13.1 и 13.2. Эпидемиологические исследования указывают на закономерную связь между инфицированием Hpylorи раком желудка. Так, в странах с высокой заболеваемостью раком желудка инфицированность Н. pylorнамного выше, чем в группах с низкой заболеваемостью им. Частота инфицирования в развитых странах составляет около 15 % населения, в менее развитых странах — до 100 %. В тех популяциях, где снизилась зараженность Н.pylor , также снизился показатель заболеваемости раком желудка. |
